Article original datant du 02/03/22
Alors que le cycle des nouvelles continue de se concentrer sur la situation en Ukraine, la FDA s’est conformée à une ordonnance du tribunal pour commencer à publier chaque mois 55 000 pages de données de Pfizer qui ont été utilisées pour autoriser leur vaccin COVID-19 produit avec BioNTech, avec le premier lot discrètement publié hier, le 1er mars.
Il y a 150 documents que le public peut maintenant télécharger ici.
L’un des documents publiés est le “Paiement des frais d’utilisation des médicaments sur ordonnance” que BioNTech a payé à la FDA le 20/04/2021 pour le “Vaccin ARNm COMIRNATY COVID-19” que la FDA a ensuite approuvé en août 2021.
Ce “paiement de frais d’utilisation de médicaments sur ordonnance” était de 2 875 842,00 $. (Source.)
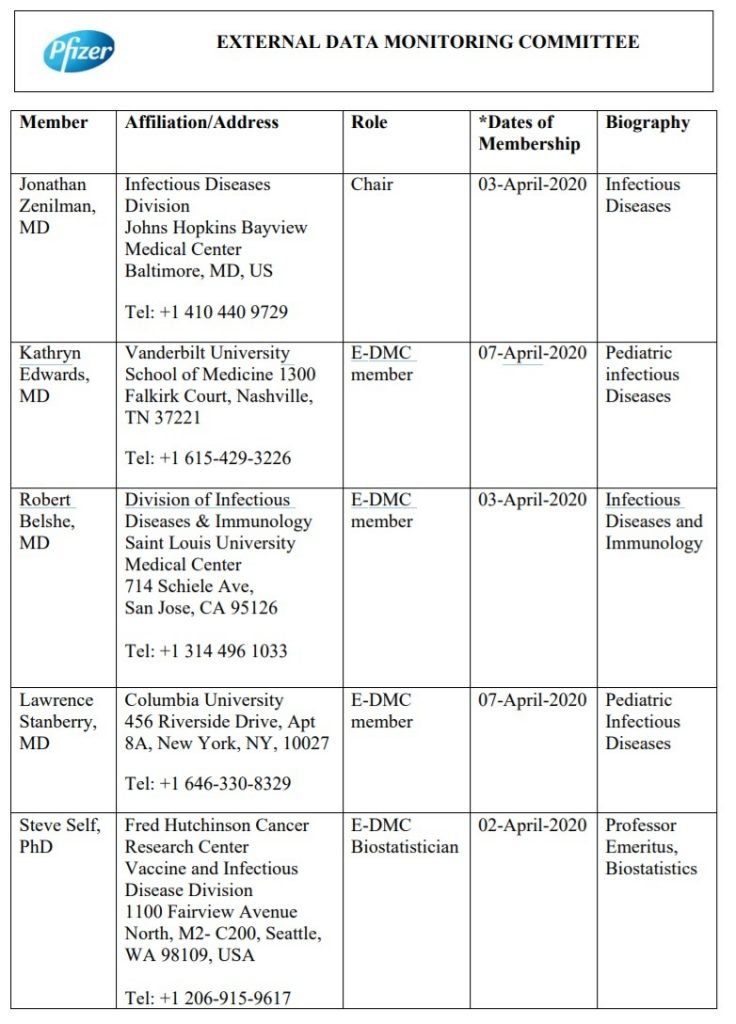
Un autre document intéressant que j’ai trouvé est le “comité externe de surveillance des données” trouvé ici.
Voici l’objectif déclaré de ce “Comité de surveillance des données externes” :
Ce Comité externe de surveillance des données (E-DMC) (ci-après dénommé “le comité”) est un groupe consultatif d’experts unique, externe et indépendant, établi pour superviser les données de sécurité et d’efficacité du programme du vaccin BNT162. La principale raison de la création du comité est de s’assurer que des garanties externes appropriées sont en place pour aider à assurer la sécurité des sujets et pour maintenir la rigueur scientifique et l’intégrité de l’étude pendant que l’essai est en cours.
Le comité examinera les données d’innocuité accumulées dans toutes les études, ainsi que les données d’efficacité dans la partie phase 2/3 de l’étude C4591001. Le comité conseillera Pfizer sur la sécurité des participants actuels et de ceux qui doivent encore être recrutés, ainsi que sur la validité scientifique continue de l’essai. En plus de l’examen de la sécurité par le comité, le personnel qualifié de Pfizer examinera les données de sécurité comme spécifié dans le plan d’examen de la surveillance de la sécurité et informera le comité des résultats significatifs. Les données d’efficacité de l’étude C4591001 seront mises à la disposition du comité lorsqu’une analyse intermédiaire de l’efficacité est prévue ou si cela est jugé nécessaire pour effectuer une évaluation des risques et des avantages.
Et pour s’assurer que ce comité fait correctement son travail pour garantir “la sécurité des sujets et maintenir la rigueur scientifique“, qui, à la FDA, est chargé de veiller à ce que cela se produise ?
Eh bien, ce n’est personne. C’est Pfizer qui est responsable, et c’est BioNTech qui l’a financé.
“Pfizer est responsable de la réalisation de cette étude. BioNTech est le sponsor réglementaire de cette étude.”
Les membres du comité doivent être exempts de “conflits d’intérêts“.
Les membres du comité rempliront un formulaire de conflit d’intérêts des membres du comité de surveillance indépendant CT22-GSOP-RF01. Les membres du comité doivent être exempts de conflits d’intérêts importants apparents. Tout conflit d’intérêts potentiel qui se développe pendant le mandat d’un membre du comité doit être divulgué par ce dernier.
Et qui, à la FDA, est chargé de s’assurer que ce comité qui supervise les “données de sécurité et d’efficacité” est exempt de conflits d’intérêts ?
Eh bien, ce n’est personne. Encore une fois, c’est Pfizer qui en est responsable.
“Pfizer déterminera si un conflit potentiel nécessite la fin de la participation au comité.”
La question qui se pose alors est la suivante : quel rôle la FDA a-t-elle joué, le cas échéant, dans le contrôle “externe” des données pour garantir l’intégrité et la sécurité d’un nouveau vaccin sur le point d’être injecté à des centaines de millions de personnes aux États-Unis ?
Il semblerait qu’elle n’ait fait qu’approuver sans discussion le processus qui était entièrement géré par Pfizer et financé par BioNTech.
Voici les membres du “Comité externe de surveillance des données” qui ont apparemment été choisis par Pfizer, surveillés par Pfizer, et enquêtés par Pfizer pour s’assurer qu’ils faisaient leur travail et qu’il n’y avait pas de “conflits d’intérêts“.
L’autre chose intéressante que révèle ce document, c’est qu’un nombre important de personnes compilant les données à examiner par cette commission étaient situées en Chine.
Rong Zhang : Responsable principal de la programmation statistique
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]Chen Xu* : Programmeur statistique senior
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]Huan Liu* Programmeur statistique principal
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]Jiyang Chen* : Programmeur statistique senior
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]Bochen Zhu* : Programmeur statistique senior
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]Ran Xiong* : Programmeur statistique senior
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Chine, 201203
[email protected]
Je me demande si les données brutes sont également situées en Chine ?
Il y a beaucoup d’autres données que je suis encore en train d’examiner, et des dizaines de milliers de pages de données supplémentaires qui doivent encore être publiées par la FDA.
Mais avec tout le monde qui regarde ce qui se passe en Ukraine en ce moment, je me demande si quelqu’un est en train de remarquer cela ?
